- 电话:+1 2027805918 传真:+1 208640718 邮箱:info@seedoctorsinusa.com 国内电话:400-7800-120
- Copyright © 2014 - 2017 Z&L International Medical(Z&L) All Rights Reserved.
- SeeDoctorsInUSA 美国好大夫(美国好医生)operated by Z&L International Medical, LLC | Technical Support by Jing
Opdivo 单独使用治疗恶性黑色素瘤的副作用分析

有一项回顾性研究汇总了Nivolumab在晚期黑色素瘤中的4项临床试验的安全性数据。结果显示,约50%接受Nivolumab单药治疗的晚期黑色素瘤会出现治疗相关选择性不良事件(AEs),多数为轻-中度,按照安全性管理共识给予处理后,多数患者AE可以缓解。接受免疫调节剂治疗不影响患者的ORR。相比于未出现AE的患者,出现治疗相关选择性AE的患者ORR更高,但两组患者的PFS无差异。
众所周知,Nivolumba是首个以PD-1为靶点的免疫检查点抑制剂,通过阻断PD-1介导的淋巴细胞负性调节通路,从而增强免疫系统对黑色素瘤细胞的识别和消除能力。现有临床试验结果显示,Nivolumba单药或联合CTLA-4抑制剂Ipilimumab在非小细胞肺癌、黑色素瘤和肾癌等瘤种中显示出较好的疗效,并在部分患者中观察到非常持久的疗效。III期研究CheckMate066入组了BRAF野生型初治晚期黑色素瘤患者,相比于化疗,Nivolumba单药显著延长患者的无进展生存期(PFS)和总生存期(OS),并且安全耐受;III期研究CheckMate037入组了既往Ipilimumab或Ipilimumab联合BRAF抑制剂(BRAF突变人群)治疗进展的晚期黑色素瘤患者,Nivolumba单药对比研究者选择的化疗,可以显著提高患者的客观缓解率(ORR)。
从现有Nivolumba的临床数据来看,治疗相关性的不良事件(AEs)主要包括皮肤,胃肠道,内分泌系统,肝,肾和肺毒性。最常见的AEs为1-2级,3-4级AE多数可以通过延迟用药或停药,联合或不联合糖皮质激素或其他抑制性免疫调节剂(immune-modulating agents,IMs)而缓解。为更好的管理免疫检查点抑制剂(如Nivolumab等)的AEs,目前已经按照受累器官分类制定了一些处理指南,主要的治疗手段包括应用糖皮质激素类的IMs等。为了进一步明确Nivolumab在晚期黑色素瘤中的安全性数据,以及评估现有安全性管理指南的实际效能,作者纳入了4个临床试验中接受Nivolumab 3mg/kg,q2w治疗的试验人群,进行汇总分析。
研究汇总了4个临床试验中接受Nivolumab3mg/kg,q2w治疗的人群,所有患者至少一次治疗,分别为:CA209-003研究,Nivolumab在晚期实体瘤中的I期剂量爬坡试验(黑色素瘤3-mg/kg队列,n=17);CA209-038研究,晚期黑色素瘤的I期标志物探索性研究,n=85;III期研究CheckMate037,n=268;III期研究CheckMate066,n=206。患者接受Nivolumab单药治疗直至疾病进展或不可耐受的毒性(III期研究)或2年(I期研究)。
共入组576例患者,中位年龄为61岁,43%的患者基线时有血清乳酸盐脱氢酶(LDH)的升高,12%的脑转移患者既往接受过局部治疗。54%(n=312)患者既往接受过ipilimumab单抗治疗。中位的治疗持续时间为3.7个月,中位的Nivolumab剂量为9剂,中位随访时间为7.2个月。出现了任意治疗相关不良事件(TRAEs)的患者相比于无TRAEs的患者,接受Nivolumab治疗的剂量更多(13剂vs. 7剂),中位治疗时间更长(6.0m vs. 2.8m)。
药物安全性评估指标包括:治疗相关性AEs(TRAEs),治疗相关选择性AEs,选择性AEs出现和缓解的时间,是否使用IMs来缓解选择性AEs。选择性AEs定义为有潜在的免疫相关致病基础,需要频繁监测和采用免疫抑制剂或内分泌替代治疗。AEs的分级依据NCI不良反应常见术语标准(CTCAE)。
截止最后随访日期,149(26%)患者死亡,最常见的死因为疾病进展(94%;140/149),未发现药物相关性死亡。任意级别的TRAEs发生率为71%(95%CI,67-75%),最常见的AEs为乏力(25%),瘙痒(17%),腹泻(13%)和皮疹(13%)。57例患者报道有3-4级的TRAEs,发生率为10%(95%CI,8-13%)。5例患者报道有3-4级的神经系统相关的AEs(均为3级):眩晕(已缓解),自身免疫性神经病变(16周后缓解),中央脱髓鞘(持续时间>3周,后因疾病进展死亡),Guillain Barr´E综合征(至最后随访日期仍未缓解,持续时间>16周),不随意性肌收缩(已缓解)。17例(3%)患者因AE终止治疗,最常见的AE为结肠炎,丙氨酸转氨酶升高,脂肪酶升高,肺炎(各2例,发生率为0.3%),未报道有胃肠穿孔。
进一步分析既往接受过ipilimumab治疗的患者,任意级别的AE和3-4级AE发生率分别未69%和8%,与总体人群AE发生率相当。进行各亚组人群分析,如年龄≥65岁,≥75岁,脑转移,M1c期,PD-L1表达>5%,LDH升高,AE发生率均与整体人群相当。
治疗相关的选择性AEs发生率为49%,最常见的发生部位为皮肤(34%)和胃肠道(13%),3-4级治疗相关的选择性AEs发生率为4%。各类AE发生率汇总见下表。
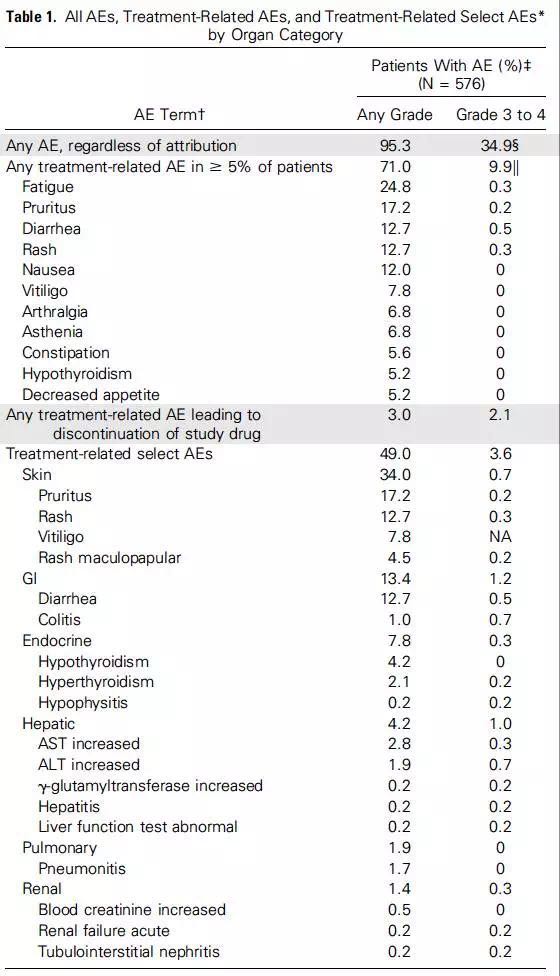
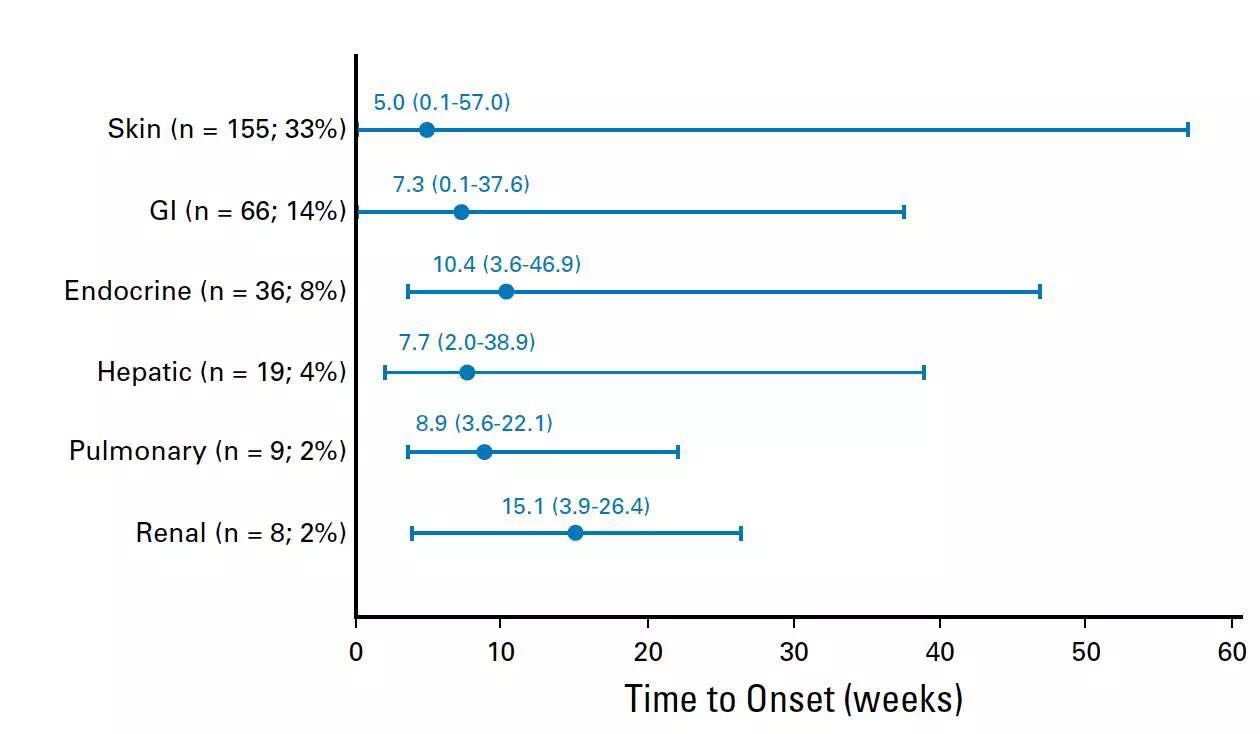
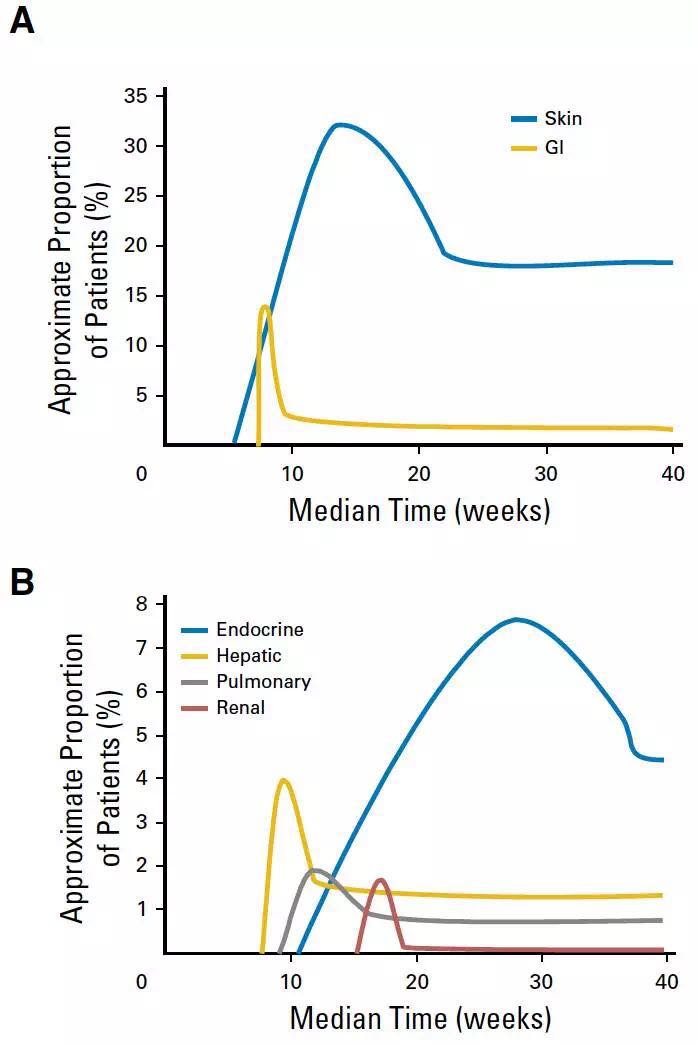
从治疗到出现各类AE的中位时间跨度较大,最早出现AE的部位为皮肤(中位时间为5周),最迟的为肾脏(中位时间为15.1周)其中最早缓解的器官为胃肠道,内分泌系统选择性AEs持续的时间最长。在282例出现了新的治疗相关性的AEs患者中,85%的患者AEs出现的时间为治疗开始的前16周内。
3. AEs的发生与ORR和PFS的关系
总体人群中,nivolumab单药的ORR为31.4%,中位PFS为4.7个月(95%CI,3.4-5.6)。多因素分析,在均衡了患者接受nivolumab的剂量,基线LDH水平,肿瘤PD-L1表达水平后,对比未出现治疗相关选择性AEs的患者,出现任意级别,1-2级和3-4级治疗相关选择性AEs的患者,ORR均有显著性的增高,见下表2。但在排除了12周内进展的患者后,比较AEs组和未出现AEs组,PFS未见差异。
4. 应用IMs管理选择性AEs
两个III期临床试验474例患者中,共114例(24%)患者接受系统性糖皮质激素患者TRAEs。此外,76例(16%)患者接受局部的糖皮质激素治疗皮肤相关AEs,5例(1%)患者接受吸入性糖皮质激素治疗。仅3例(0.6%)患者需要接受额外的免疫抑制剂:CheckMate 037研究中2例患者因3级关节炎和4级脂肪酶升高接受了英夫利昔治疗;CheckMate 066研究中1例患者因后续接受ipilimumab单抗治疗出现3级肝炎,接受了霉酚酸治疗。接受IMs治疗后,58%的AEs得以缓解,缓解需要的中位时间从3.3周到28.6周。
5. 系统性IMs与患者的疗效
114例患者接受了系统性IMs治疗来缓解TRAEs,对比未接受系统性IMs治疗的患者,两组ORR无统计学差异。
结论
本研究是第一个大样本量评估nivolumab单药安全性的汇总分析。约50%的患者接受nivolumab治疗后,会发生治疗相关选择性AEs,但多数AEs为轻-中度,3-4级的AEs发生率较低(<4%)。最常见的发生部位为皮肤、胃肠道和内分泌器官。
参考文献:
JeffreyS. Weber, F. Stephen Hodi, Jedd D. Wolchok, et al. Safety Profile of NivolumabMonotherapy: A Pooled Analysis of Patients With Advanced Melanoma. Journal ofClinical Oncology , 2016. DOI: 10.1200/JCO.2015.66.1389
