- 电话:+1 2027805918 传真:+1 208640718 邮箱:info@seedoctorsinusa.com 国内电话:400-7800-120
- Copyright © 2014 - 2017 Z&L International Medical(Z&L) All Rights Reserved.
- SeeDoctorsInUSA 美国好大夫(美国好医生)operated by Z&L International Medical, LLC | Technical Support by Jing
骨瘤新药
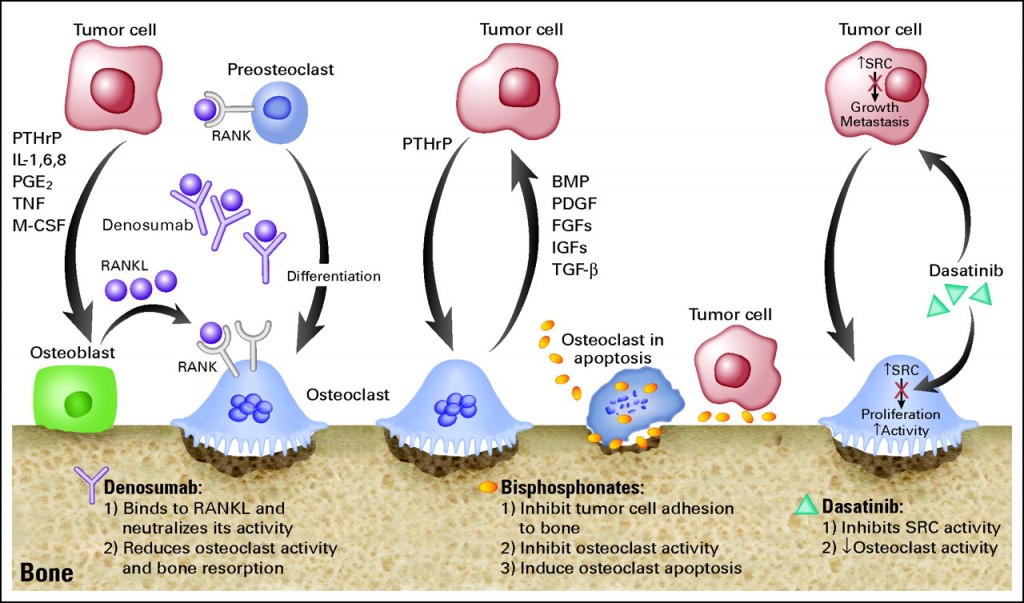
2013年6月13日,美国食品和药物管理局 (FDA) 批准了Denosumab(狄迪诺塞麦,商品名 XGEVA ?皮下注射,美国 Amgen 公司生产)用于治疗成人和骨骼发育成熟的青少年的骨巨细胞瘤, 适应症包括不能手术切除或手术切除可能导致严重伤残的病患。Denosumab的批准是基于两个多医疗中心参与的临床试验的有效结果。该临床试验招收成人 或骨骼发育成熟的青少年骨巨细胞瘤病例,这些病 例要么是复发,或不能手术切除,或手术切除可能导致严重伤残的病患。 一共有304例患者接受了Denosumab的治疗。 平均年龄为33岁(范围: 13-83岁), 共10例患者是骨骼发育成熟的青少年( 13-17岁)。 187 (61%)例患者有Denosumab治疗前后的影像从而可以作疗效评估。 其中47例有效,有效率为25%。 所有的疗效均为肿瘤部分缩小。平均起效时间为3个月。 疗效持续至少8个月的占51%。
Denosumab最常见的副作用为关节痛,头痛,恶心,腰痛,乏力,肢体疼痛。最常见的严重副作用为颚骨坏死和骨髓炎。
Denosumab的推荐剂量是120毫克皮下注射,第一个月的第8,15和28天注射一次,以后每4周一次。
若需完整的处方信息,请访问: 125320s094lbl