- 电话:+1 2027805918 传真:+1 208640718 邮箱:info@seedoctorsinusa.com 国内电话:400-7800-120
- Copyright © 2014 - 2017 Z&L International Medical(Z&L) All Rights Reserved.
- SeeDoctorsInUSA 美国好大夫(美国好医生)operated by Z&L International Medical, LLC | Technical Support by Jing
肺癌新药
肺癌新药:Nivolumab(商品名Opdivo)对于晚期转移性鳞状非小细胞肺癌有很好的疗效
2015年3月4日,美国食品和药物管理局(FDA)批准了Nivolumab(商品名Opdivo,美国施贵宝公司生产),用于治疗正在或接受过 铂类为基础化疗后仍进展的转移性磷状非小细胞肺癌(NSCLC)。Nivolumab是一种结合于PD-1受体的单克隆抗体,通过阻断PD-1和PD- L1及PD-L2间的相互作用,从而阻断 PD-1通路介导的免疫抑制反应,包括抗肿瘤免疫反应。
该批准是基于一项临床试验的有效结果,该研究显示Nivolumab可延长总生存期(OS)。该临床研究纳入的患者为正在或接受过铂类为基础化疗后 仍进展的转移性磷状非小细胞肺癌患者,患者被随机分配到Nivolumab组或多西他赛组。试验结果显示,Nivolumab优于多西他 赛,Nivolumab组的中位总生存期为9.2个月,而多西他赛组的则为6个月。
最常见的的不良反应(发生率大于或等于30%)为疲劳、呼吸困难、肌肉骨骼疼痛、食欲下降和咳嗽。至少5%服用Nivolumab的患者发生的最常见3级 和4级药物不良反应为呼吸困难、疲劳和肌肉骨骼疼痛。免疫介导的显著临床不良反应包括肺炎、肠炎、肝炎、肾炎/肾功能不全、甲状腺功能低下和甲状腺功能亢 进。
Nivolumab的推荐剂量为:3毫克/每公斤体重,60分钟静脉点滴,每两周一次。
肺癌新药:Ceritinib(商品名Zykadia)对ALK阳性的非小细胞肺癌有很好的疗效。
2014年4月29日,美国食品和药物管理局(FDA)加快批准了Ceritinib(商品名Zykadia,瑞士诺华制药公司生产)用于对Crizotinib治疗无效或不可耐受、ALK阳性的转移性非小细胞肺癌(NSCLC)的治疗。
该批准是基于一项临床研究的有效结果,Crizotinib的客观有效率(ORR)为44%,有效时期(DOR)为7.1个月。
Ceritinib最常见的不良反应(大于或等于25%的发病率)包括腹泻、恶心、肝转氨酶增高、呕吐、腹痛、疲劳、食欲减退和便秘。
Ceritinib的推荐剂量是750毫克(5粒150毫克),口服,每天一次,直至疾病恶化或病人不再耐受。Ceritinib应该在饭前至少一个小时或饭后至少两个小时服用。
Zykadia 150粒(每粒150毫克)在美国的价格大约是14600美元。
关于Ceritinib的全面处方信息,请参阅: 205755lbl

肺癌新药:Afatinib(商品名 Gilotrif)对非小细胞肺癌有很好的疗效
肺癌新药:Afatinib(商品名 Gilotrif)对非小细胞肺癌有很好的疗效。2013年7月12日,美国食品和药物管理局批准了Afatinib(Gilotrif) 片,Boehringer Ingelheim 制药公司生产)作为治疗转移性非小细胞肺癌(NSCLC)的一线治疗药物。适应症为该转移性非小细胞肺癌须有表皮生长因子受体(EGFR)基因第19外显 子缺失或外显子21(L858R)替代突变(须经美国食品和药物管理局批准的标准测试方法检测)。对具有其他的表皮生长因子(EGFR)基因突变的转移性 非小细胞肺癌,Afatinib的安全性和有效性则尚未完全确立。
Afatinib的批准基于最新的3期临床试验的好结果。一个由多个国际性医疗中心共同参与的随机临床试验证明Afatinib对提高存活期 有明显疗效。共有345例有EGFR突变的转移性非小细胞肺癌患者参加此临床试验。患者被随机分为两组,一组每日一次口服Afatinib 40毫克(230名患者),另一组服用常规化疗药物Pemetrexed/Cisplatin(115名患者)。所有患者也根据EGFR的突变状态(19 号外显子缺失一组,外显子21 L858R替代一组,或“其他”突变一组),种族(亚洲与非亚洲)进行进一步随机分组,最终疗效由一个独立审查委员会(IRC)根据癌症无恶化生存期 (PFS)的结果进行评估。
在345例患者中,65%为女性,平均年龄为61岁,26%为白人,72%为亚洲人。多数患者的肿瘤有19号外显子缺失(49%)或外显子21(L858R)替代(40%)EGFR突变,而余下的11%有’其他’突变。
根据IRC的结果,被分配到Afatinib治疗组的患者的无恶化生存期(PFS)明显延长。Afatinib治疗组的平均无恶化生存期 (PFS)为11.1个月,而化疗组的平均无恶化生存期(PFS)为6.9个月。Afatinib和常规化疗组的客观有效率(ORR)分别为50.4%和 19.1%。两个组之间的整体存活率(OS)并未发现统计学差异。Afatinib组中,有19号外显子缺失或外显子21(L858R)突变的肿瘤患者, 平均无恶化生存期(PFS)为13.6个月,而常规化疗组为6.9个月。
Afatinib组中,最常见的不良反应(大于或等于20%的发病率)包括腹泻,痤疮样皮疹/皮炎,口腔炎,甲沟炎,皮肤干燥,食欲减退和瘙痒。
接受Afatinib治疗的患者中,29%出现过严重不良反应。最常见的严重不良反应为腹泻(6.6%),呕吐(4.8%),呼吸困难,乏 力,低血钾(各占1.7%)。致命的不良反应包括:肺毒性/间质性肺疾病(ILD)类的不良反应(1.3%),败血症(0.43%),肺炎 (0.43%)。
Afatinib的推荐剂量是口服每天一次,每次40毫克,持续直至疾病明显恶化或病人不再耐受。Afatinib应该在饭前至少一个小时或饭后至少两个小时服用。
关于Afatinib的全面处方信息,请参阅:201292s000lbl

肺癌新药:Erlotinib(埃罗替尼,商品名 Tarceva 它赛瓦)被批准用于非小细胞肺癌的一线治疗
2013年5月14日,美国食品和药物管理局(FDA)批准了Erlotinib(埃罗替尼) (商品名:Tarceva(它赛瓦),日本AstellasPharma制药公司生产)作为治疗转移性非小细胞肺癌( NSCLC )的一线治疗药物。适应症为该转移性非小细胞肺癌须有表皮生长因子受体(EGFR)基因第19外显子缺失或外显子21(L858R)替代突变。FDA同时 还批准了cobas ? EGFR基因突变检测方法。
Erlotinib的批准是基于一项多中心参与的,随机的临床试验结果。该实验将带有表皮生长因子受体(EGFR ) 19号外显子缺失或外显子21 ( L858R)替代突变的转移性非小细胞肺癌( NSCLC )患者随机分为两组。第一组使用Erlotinib,第二组使用铂类为基础的双药化疗。
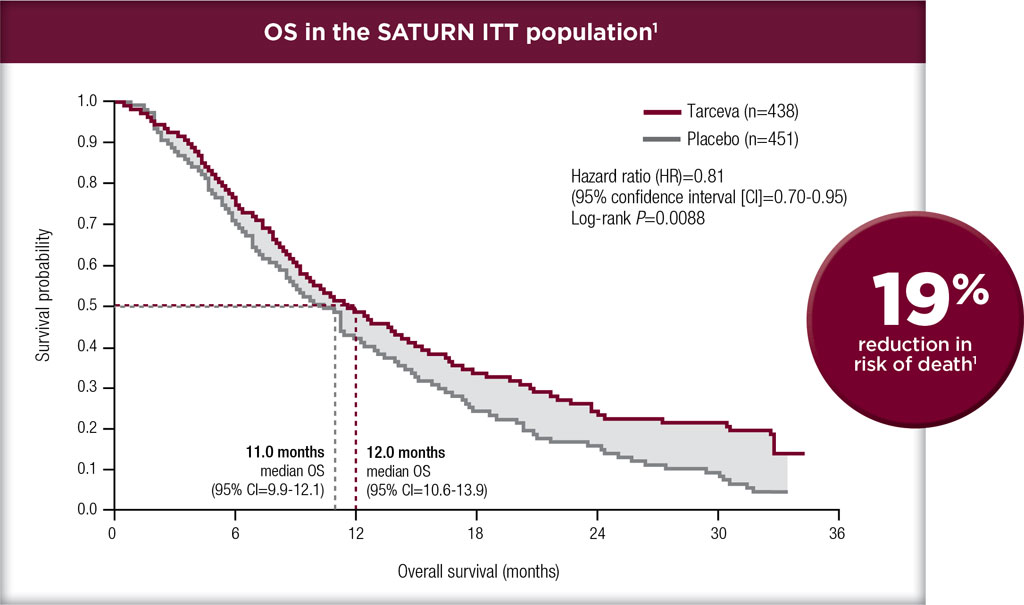
试验结果表明,Erlotinib组的平均无恶化生存期(PFS)为10.4个月,化疗组的平均无恶化生存期(PFS)则为5.2个月。从总 体生存率(OS)来看,Erlotinib组为22.9个月,化疗组为19.5个月。Erlotinib组的客观有效率(ORR )为65%,化疗组则为16 %。在研究者确定疾病进展后,以铂类药物为基础的化疗组中,大部分的患者(82%)随后都接受了表皮生长因子受体酪氨酸激酶抑制剂的进一步治疗。
Erlotinib最常见的副作用主要包括:皮疹,腹泻,乏力,咳嗽,呼吸困难,食欲下降。而最常见的严重副作用主要是皮疹和腹泻。
Erlotinib的推荐剂量为每日150毫克,该药应在至少饭前一个小时以前或饭后两个小时以后服用。治疗应持续至病情恶化或病人不再耐受。
若需完整的处方信息,请访问:021743s018lbl
2015年3月4日,美国食品和药物管理局(FDA)批准了Nivolumab(商品名Opdivo,美国施贵宝公司生产),用于治疗正在或接受过 铂类为基础化疗后仍进展的转移性磷状非小细胞肺癌(NSCLC)。Nivolumab是一种结合于PD-1受体的单克隆抗体,通过阻断PD-1和PD- L1及PD-L2间的相互作用,从而阻断 PD-1通路介导的免疫抑制反应,包括抗肿瘤免疫反应。
该批准是基于一项临床试验的有效结果,该研究显示Nivolumab可延长总生存期(OS)。该临床研究纳入的患者为正在或接受过铂类为基础化疗后 仍进展的转移性磷状非小细胞肺癌患者,患者被随机分配到Nivolumab组或多西他赛组。试验结果显示,Nivolumab优于多西他 赛,Nivolumab组的中位总生存期为9.2个月,而多西他赛组的则为6个月。
最常见的的不良反应(发生率大于或等于30%)为疲劳、呼吸困难、肌肉骨骼疼痛、食欲下降和咳嗽。至少5%服用Nivolumab的患者发生的最常见3级 和4级药物不良反应为呼吸困难、疲劳和肌肉骨骼疼痛。免疫介导的显著临床不良反应包括肺炎、肠炎、肝炎、肾炎/肾功能不全、甲状腺功能低下和甲状腺功能亢 进。
Nivolumab的推荐剂量为:3毫克/每公斤体重,60分钟静脉点滴,每两周一次。

肺癌新药:Ceritinib(商品名Zykadia)对ALK阳性的非小细胞肺癌有很好的疗效。
2014年4月29日,美国食品和药物管理局(FDA)加快批准了Ceritinib(商品名Zykadia,瑞士诺华制药公司生产)用于对Crizotinib治疗无效或不可耐受、ALK阳性的转移性非小细胞肺癌(NSCLC)的治疗。
该批准是基于一项临床研究的有效结果,Crizotinib的客观有效率(ORR)为44%,有效时期(DOR)为7.1个月。
Ceritinib最常见的不良反应(大于或等于25%的发病率)包括腹泻、恶心、肝转氨酶增高、呕吐、腹痛、疲劳、食欲减退和便秘。
Ceritinib的推荐剂量是750毫克(5粒150毫克),口服,每天一次,直至疾病恶化或病人不再耐受。Ceritinib应该在饭前至少一个小时或饭后至少两个小时服用。
Zykadia 150粒(每粒150毫克)在美国的价格大约是14600美元。
关于Ceritinib的全面处方信息,请参阅: 205755lbl


肺癌新药:Afatinib(商品名 Gilotrif)对非小细胞肺癌有很好的疗效
肺癌新药:Afatinib(商品名 Gilotrif)对非小细胞肺癌有很好的疗效。2013年7月12日,美国食品和药物管理局批准了Afatinib(Gilotrif) 片,Boehringer Ingelheim 制药公司生产)作为治疗转移性非小细胞肺癌(NSCLC)的一线治疗药物。适应症为该转移性非小细胞肺癌须有表皮生长因子受体(EGFR)基因第19外显 子缺失或外显子21(L858R)替代突变(须经美国食品和药物管理局批准的标准测试方法检测)。对具有其他的表皮生长因子(EGFR)基因突变的转移性 非小细胞肺癌,Afatinib的安全性和有效性则尚未完全确立。
Afatinib的批准基于最新的3期临床试验的好结果。一个由多个国际性医疗中心共同参与的随机临床试验证明Afatinib对提高存活期 有明显疗效。共有345例有EGFR突变的转移性非小细胞肺癌患者参加此临床试验。患者被随机分为两组,一组每日一次口服Afatinib 40毫克(230名患者),另一组服用常规化疗药物Pemetrexed/Cisplatin(115名患者)。所有患者也根据EGFR的突变状态(19 号外显子缺失一组,外显子21 L858R替代一组,或“其他”突变一组),种族(亚洲与非亚洲)进行进一步随机分组,最终疗效由一个独立审查委员会(IRC)根据癌症无恶化生存期 (PFS)的结果进行评估。
在345例患者中,65%为女性,平均年龄为61岁,26%为白人,72%为亚洲人。多数患者的肿瘤有19号外显子缺失(49%)或外显子21(L858R)替代(40%)EGFR突变,而余下的11%有’其他’突变。
根据IRC的结果,被分配到Afatinib治疗组的患者的无恶化生存期(PFS)明显延长。Afatinib治疗组的平均无恶化生存期 (PFS)为11.1个月,而化疗组的平均无恶化生存期(PFS)为6.9个月。Afatinib和常规化疗组的客观有效率(ORR)分别为50.4%和 19.1%。两个组之间的整体存活率(OS)并未发现统计学差异。Afatinib组中,有19号外显子缺失或外显子21(L858R)突变的肿瘤患者, 平均无恶化生存期(PFS)为13.6个月,而常规化疗组为6.9个月。
Afatinib组中,最常见的不良反应(大于或等于20%的发病率)包括腹泻,痤疮样皮疹/皮炎,口腔炎,甲沟炎,皮肤干燥,食欲减退和瘙痒。
接受Afatinib治疗的患者中,29%出现过严重不良反应。最常见的严重不良反应为腹泻(6.6%),呕吐(4.8%),呼吸困难,乏 力,低血钾(各占1.7%)。致命的不良反应包括:肺毒性/间质性肺疾病(ILD)类的不良反应(1.3%),败血症(0.43%),肺炎 (0.43%)。
Afatinib的推荐剂量是口服每天一次,每次40毫克,持续直至疾病明显恶化或病人不再耐受。Afatinib应该在饭前至少一个小时或饭后至少两个小时服用。
关于Afatinib的全面处方信息,请参阅:201292s000lbl

肺癌新药:Erlotinib(埃罗替尼,商品名 Tarceva 它赛瓦)被批准用于非小细胞肺癌的一线治疗
2013年5月14日,美国食品和药物管理局(FDA)批准了Erlotinib(埃罗替尼) (商品名:Tarceva(它赛瓦),日本AstellasPharma制药公司生产)作为治疗转移性非小细胞肺癌( NSCLC )的一线治疗药物。适应症为该转移性非小细胞肺癌须有表皮生长因子受体(EGFR)基因第19外显子缺失或外显子21(L858R)替代突变。FDA同时 还批准了cobas ? EGFR基因突变检测方法。
Erlotinib的批准是基于一项多中心参与的,随机的临床试验结果。该实验将带有表皮生长因子受体(EGFR ) 19号外显子缺失或外显子21 ( L858R)替代突变的转移性非小细胞肺癌( NSCLC )患者随机分为两组。第一组使用Erlotinib,第二组使用铂类为基础的双药化疗。
试验结果表明,Erlotinib组的平均无恶化生存期(PFS)为10.4个月,化疗组的平均无恶化生存期(PFS)则为5.2个月。从总 体生存率(OS)来看,Erlotinib组为22.9个月,化疗组为19.5个月。Erlotinib组的客观有效率(ORR )为65%,化疗组则为16 %。在研究者确定疾病进展后,以铂类药物为基础的化疗组中,大部分的患者(82%)随后都接受了表皮生长因子受体酪氨酸激酶抑制剂的进一步治疗。
Erlotinib最常见的副作用主要包括:皮疹,腹泻,乏力,咳嗽,呼吸困难,食欲下降。而最常见的严重副作用主要是皮疹和腹泻。
Erlotinib的推荐剂量为每日150毫克,该药应在至少饭前一个小时以前或饭后两个小时以后服用。治疗应持续至病情恶化或病人不再耐受。
若需完整的处方信息,请访问:021743s018lbl


